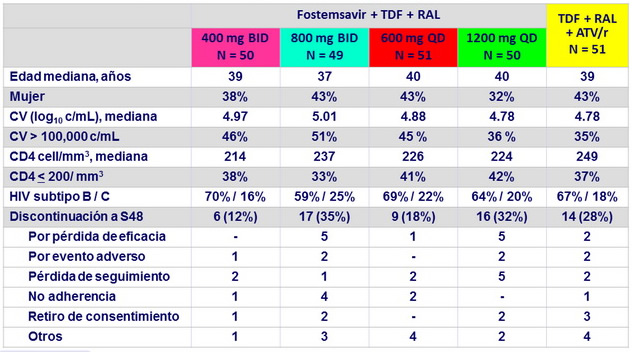
Características basales y disposición
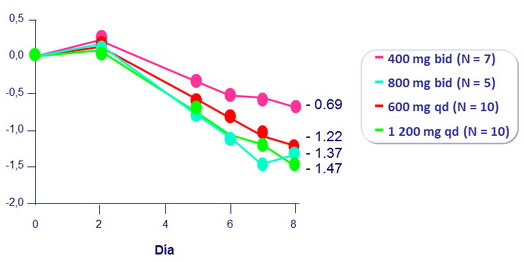
7 días de monoterapia con fostemsavir
Media de cambio de CV desde el basal (log10 c/ml)
CV < 50 c/ mL o < 400 c/ mL a S24
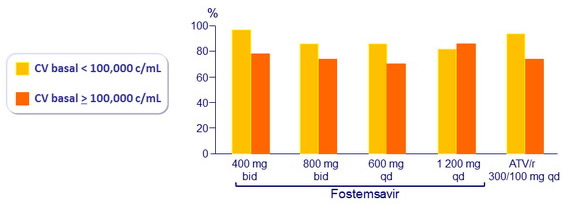
CV < 50 c/ml a S24 por CV basal (observado)
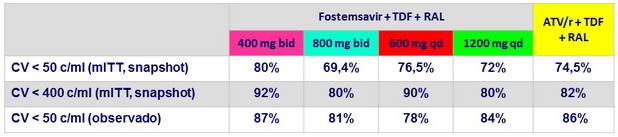
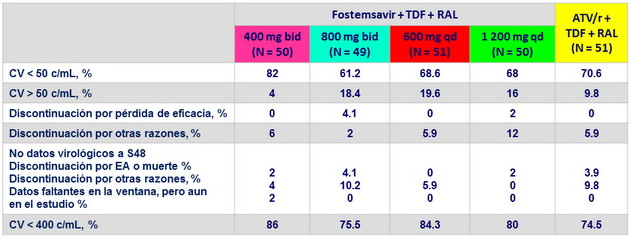
CV < 50 c/ mL o < 400 c/ mL a S48, mITT snapshot
CV < 50 c/ mL a S48, observado

Datos de seguridad a S48
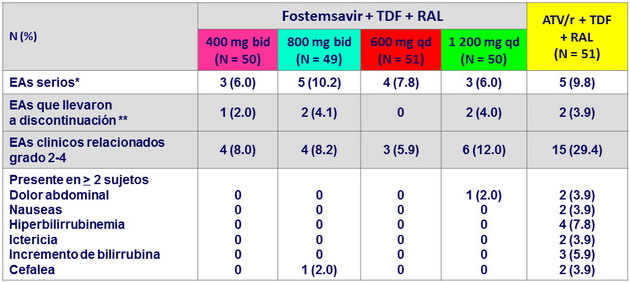
* Absceso anal, encefalitis herpética, sobredosis (3), tuberculosis extrapulmonar (2), herpes zoster, dolor abdominal, mialgia,
aborto espontaneo, falla renal aguda, celulitis (2), linfangitis, colecistitis crónica, dolor de espalda, neumonía, pielonefritis,
diarrea, colelitiasis, migraña
** Uso de sustancias ilegales, tuberculosis extrapulmonar (3),falla renal aguda, distensión abdominal, flatulencia, nausea, ictericia ; 6/7 EA llevaron a la discontinuación en las primeras 24 semanas
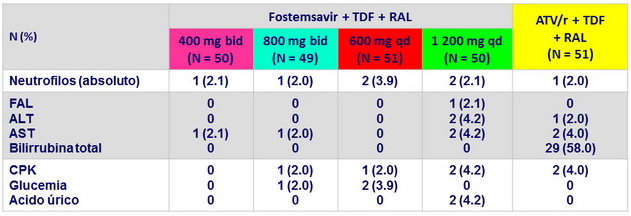
Anomalías de laboratorio grado 3-4
(≥ 2
sujetos)
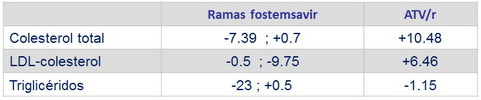
Media de cambio desde el basal a S48 en lípidos, mg/ dL