Diseño
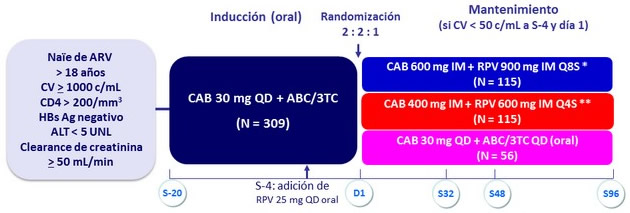
* CAB IM, dosis de carga de 800 mg al D1 y 600 mg a S4
** CAB IM, dosis de carga de 800 mg at D1
Q8S: inyección cada 8 semanas ; Q4S: inyección cada 4 semanas
Fase de inducción: CV < 50 c/ mL (ITT-E) luego de 20 semanas = 91.3 % ; discontinuación en 18/309 pacientes, incluyendo 6 por eventos adversos y 2 por falta de eficacia
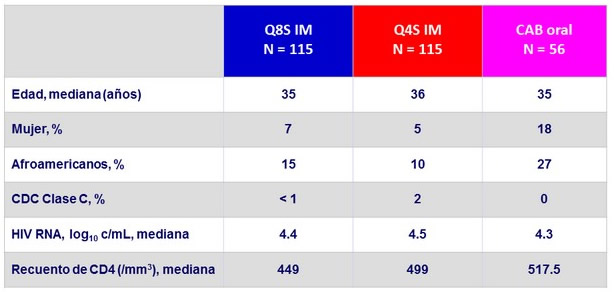
Características basales (ITT-fase de mantenimiento, expuestos)
HIV RNA < 50 c/ mL a S48 (análisis snapshot , ITT-ME)
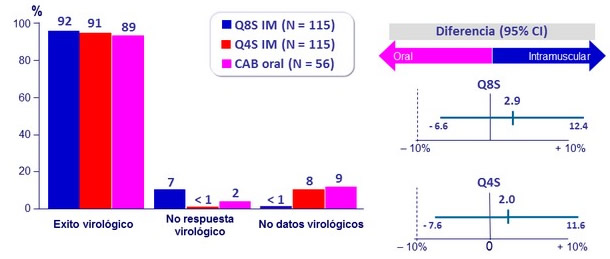
- No inferioridad de los dos regímenes IM vs CAB oral
- Fallo virológico definido por protocolo: 2 en el grupo Q8S, 1 en el grupo oral
- Emergencia de resistencia (genotipo): N = 1 (grupo Q8S): NNRTI (K103N, E138G, K238T), INSTI (Q148R)
Eventos adversos y anormalidades de laboratorio
(ISR = Reacción en el sitio de inyección)
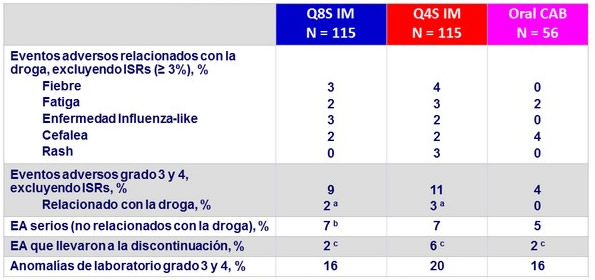
a Q8S (N = 2): enfermedad influenza- like , resfrío y dolor; Q4S (N = 4): enfermedad influenza- like , rash , depresión, y psicosis, una muerte (epilepsia)
c Q8S (N = 2): ISR, ISR/ resfrio /dolor corporal; Q4S (N = 7): vasculitis de Churg -Strauss, hepatitis C, depresión, epilepsia psicosis, rash , y trombosis de vena mesentérica; CAB oral (N = 1): hepatitis C
Incidencia global de reacciones en el sitio de inyección,
por visita (% pacientes con ISR)
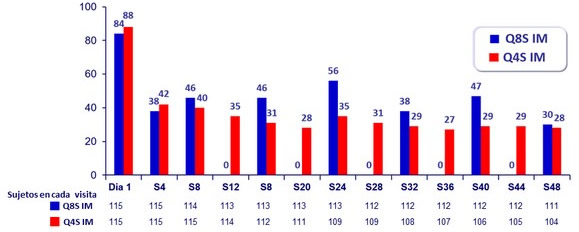
- 99% de los ISRs fueron leves o moderados (82%) o moderados (17%), grado 3 fueron 12 en Q8S (< 1%) y 10 en Q4S (< 1%)
- La duración mediana fue de 3.0 días en ambos grupos, y 90% resolvieron en 7 días
- Los eventos ISR mas comunes fueron dolor (67%), nódulos (7%), e inflamación (6%)
- El número de sujetos que reportaron ISRs disminuyó con el tiempo, de 86% (D1) a 29% (S48)
- 2/230 sujetos (< 1%) se retiraron como resultado de reacciones en el sitio de inyección (Q8S)
Farmacocinética (concentración media en plasma ± DS)
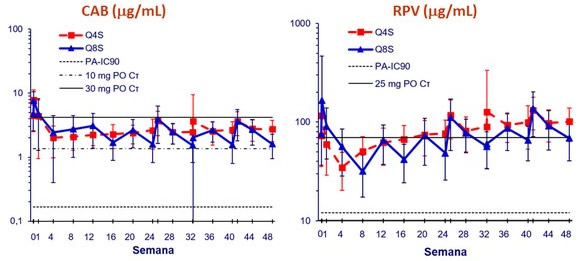
Cτ ,
concentración valle ; PA-IC90, concentración inhibitoria 90% ajustada por unión a proteínas
- Q4S y Q8S: los niveles en estado estable se aproximan a los de una dosis diaria por vía oral



