Essais cliniques comparatifs pour le traitement antirétroviral de 1ère ligne depuis 2006
Comparaison INNTI vs IP/r
Etude ARTEN : NVP vs ATV/r, �en association à TDF/FTC
Article original : Antivir Ther. 2011;16(3):339-48 - V Soriano, HIV Med. 2011 Jul;12(6):374-82 - D Podzamczer
Dernière mise à jour :
18/10/2014
Pr François Raffi
Centre Hospitalier Universitaire
Nantes, France
- NVP a démontré, à S48, une efficacité antivirale non-inférieure à ATV/r, lorsque administrés en association à TDF/FTC, malgré un taux d’arrêt lié au traitement plus élevé avec NVP que avec ATV/r
- NVP BID et QD ont une efficacité et une tolérance similaires
- Le respect du taux de CD4 recommandé pour l’initiation d’un traitement en 1ère ligne par NVP explique probablement la faible fréquence d’élévation des enzymes hépatiques et des arrêts pour toxicité hépatique
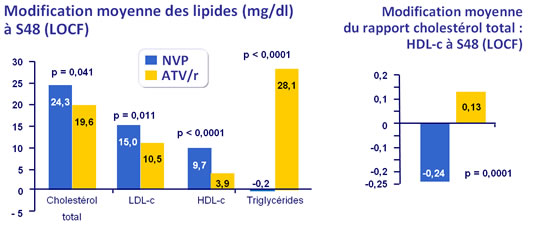
- NVP est associé avec un profil lipidique moins athérogène �que ATV/r
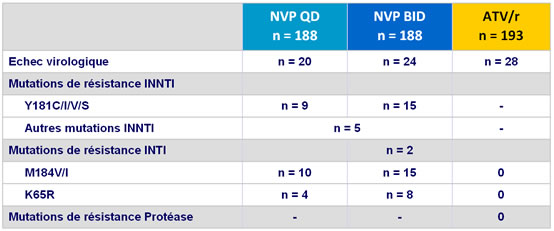
- A l’échec virologique, il y avait un taux élevé de mutations �de résistance sélectionnées avec NVP et aucune avec ATV/r
Schéma d'étude :
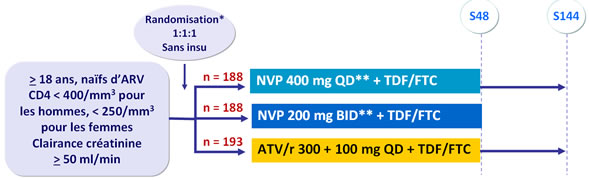
* Randomisation stratifiée sur ARN VIH (≤ ou > 100 000 c/ml) et CD4 (≥ ou < 50/mm3) à l’inclusion
** Dose initiale de NVP : 200 mg QD pendant les 2 premières semaines
Objectif :
- Non infériorité de NVP (2 groupes combinés) comparé à ATV/r pour le critère principal : % ARN VIH < 50 c/ml à S24, S36 et S48 en intention de traiter, �avec non compléteur égal échec (taux de significativité bilatéral à 5 %, borne inférieure de l’IC 95 % de la différence = -12 %, puissance 80 %)
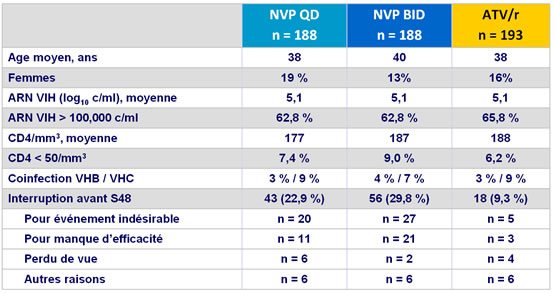
Caractéristiques à l'inclusion et devenir des patients :
Réponse au traitement à S48 :
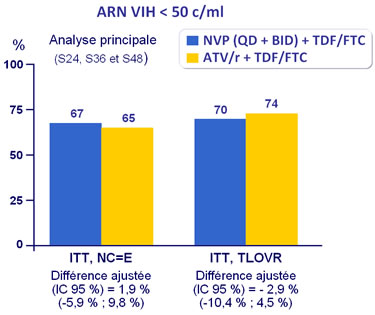
Réponse virologique similaire pour NVP BID (66,5 %) et QD (67 %)
ITT, snapshot : taux de réponse
-
NVP : 67,3 %
-
ATV/r : 78,8 %
Différence - 11,1 % �(IC 95 % : -18,4 ; - 3,9 ; p = 0,003)
Augmentation moyenne CD4/mm3 à S48 :
+ 170 pour NVP
+ 186 pour ATV/r
Evénements indésirables au cours des 48 semaines
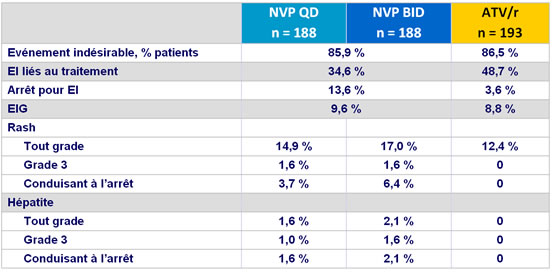
La majorité des rash sous NVP sont survenus durant la période de lead-in
Pas de rash de grade 4
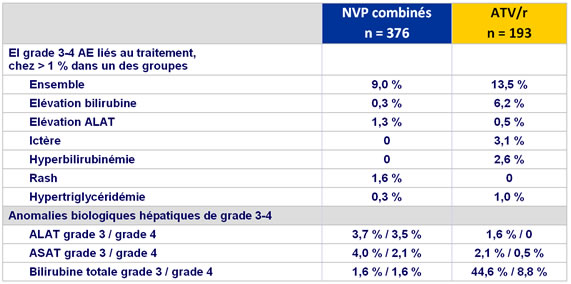
Evénements indésirables de grade 3 et 4 et augmentation �des enzymes hépatiques
Valeurs moyennes des lipides à l’inclusion, S48 (LOCF) et de la modification depuis l’inclusion (LOCF)
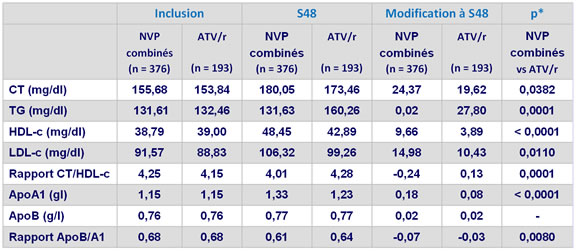
* ANCOVA en contrôlant sur la CV et les CD4 à l’inclusion
Tolérance :
- Incidence des arrêts pour événement indésirable : �13,6 % NVP vs 3,6 % ATV/r
- Rash : 16 % NVP vs 12,4 % ATV/r (arrêt pour rash : 5,1 % vs 0 %)
- Hépatite : 1,9 % NVP vs 0 % ATV/r
- Elévation grade 3-4 des enzymes hépatiques : 4 % NVP vs 1,5 % ATV/r
- Hyperbilirubinémie grade 3-4 :�3,2 % NVP vs 54,4 % ATV/r
- Pas de cas de Stevens-Johnson, �de nécrolyse épidermique, �ni de décès par toxicité cutanée �ou hépatique
Données de résistance :
- Echec virologique : ARN VIH > 50 c/ml sur 2 prélèvements consécutifs �à au moins 2 semaines d’intervalle
 Retour au sommaire Retour au sommaire
|



