Essais cliniques comparatifs pour le traitement antirétroviral de 1ère ligne depuis 2006
Comparaison INNTI vs IP/r
ACTG A5142 : [(EFV vs LPV/r) + 2 INTI] vs EFV + LPV/r
Article original : N Engl J Med. 2008 May 15;358(20):2095-106 - SA Riddler
Dernière mise à jour :
16/01/2009
Pr François Raffi
Centre Hospitalier Universitaire
Nantes, France
- Etude randomisée de 96 semaines comparant 3 schémas pour le traitement initial de l’infection VIH
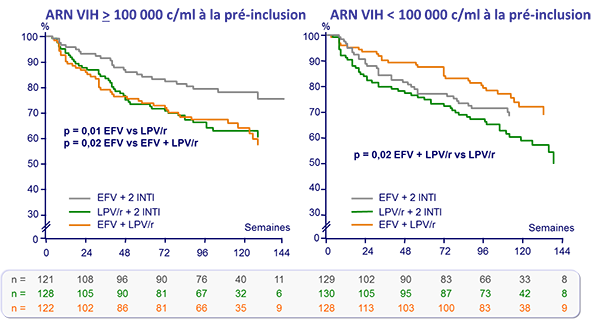
- Moins d’échec virologique avec EFV + 2 INTI qu’avec LPV/r + 2 INTI
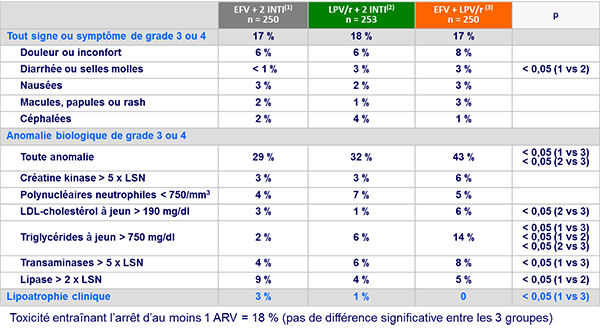
- Schéma épargnant les INTI (EFV + LPV/r) : efficacité virologique similaire à EFV �+ 2 INTI mais plus de résistance aux INNTI et d’anomalies lipidiques
- Tendance non significative à un échec thérapeutique plus rapide avec LPV/r + 2 INTI qu’avec EFV + 2 INTI
- Pas de différence significative entre les 3 groupes pour le délai de survenue de toxicité conduisant à l’arrêt du traitement
- Augmentation plus faible des CD4 avec EFV + 2 INTI par rapport aux 2 groupes avec LPV/r
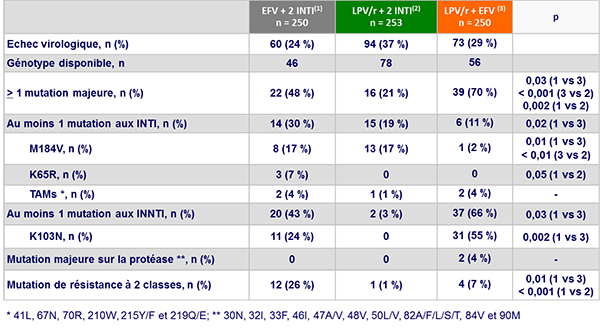
- Emergence de résistance : résistance aux INTI non significativement différente entre EFV + 2 INTI et LPV/r + 2 INTI ; résistance à 2 classes significativement plus fréquente avec EFV + 2 INTI ; échec à EFV + INTI associé à une fréquence élevée de résistance aux INNTI ; échec à LPV/r + 2 INTI non associé à une résistance à LPV
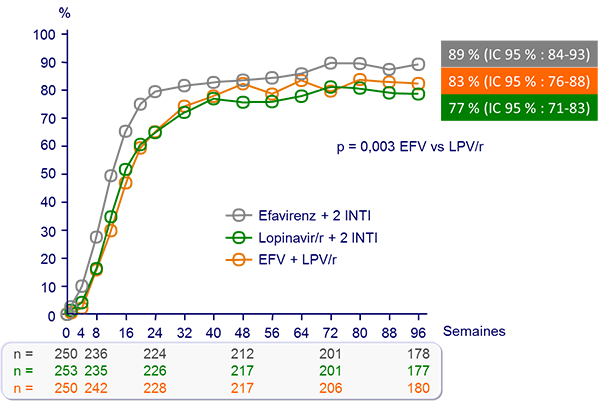
- Cette étude met en évidence une supériorité modeste de l’efficacité de EFV + 2 INTI par rapport à LPV/r + 2 INTI pour le traitement initial de l’infection VIH-1
- Les résultats soulignent la complexité du choix du traitement initial, qui doit prendre en compte de multiples facteurs dont l’efficacité virologique et immunologique, la tolérance, la toxicité à court et à long terme, et les conséquences en termes de résistance en cas d’échec virologique
Schéma d'étude :
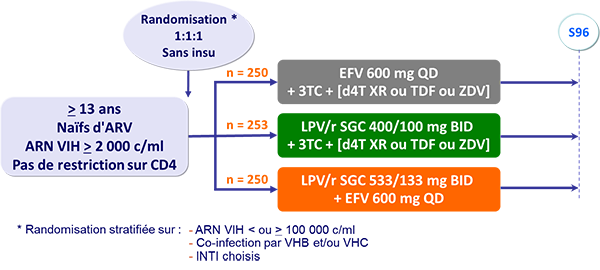
- 3TC = 300 mg QD ou 150 mg BID, chez tous les patients
- 2nd INTI (d4T XR 100 mg BID [75 mg si < 60 kg] ou TDF [300 mg QD] ou ZDV 300 mg BID) choisi par l’investigateur avant la randomisation
- Suivi = 96 semaines après inclusion du dernier patient
Objectifs :
- Délai de survenue de l’échec virologique : diminution de l’ARN VIH < 1 log10 c/ml ou rebond avant S32, ou absence d’obtention d’ARN VIH < 200 c/ml ou rebond après S32. Confirmation de l’échec virologique requis dans les 4 semaines. Si pas d’obtention d’un échantillon pour confirmation, le cas était considéré comme échec
- Délai de survenue de l’échec thérapeutique : échec virologique ou arrêt pour toxicité de l’un �des produits du traitement initial (prise en compte du 1er événement)�
Analyses :
- Analyses en intention de traiter (ITT) stratifiées sur les 3 facteurs de randomisation, incluant tous les patients ayant reçu au moins une dose de médicaments de l’étude
- Si interruption ou intolérance, le suivi était poursuivi pour évaluer la survenue d’échec virologique
- Si pas d’échec virologique ni thérapeutique, le suivi était censuré à la dernière visite
- Données manquantes en raison de visites non faites, perdus de vue, ou censure non prise �en compte
- Puissance de 85 % pour mettre en évidence une réduction de 56 % du risque d’échec virologique
- Puissance de 90 % pour mettre en évidence une réduction de 52 % du risque d’échec thérapeutique
- Critères principaux de jugement évalués par courbe de survie (Kaplan-Meier) avec une significativité statistique des risques relatifs entre les bras de traitement déterminée par �p < 0,014
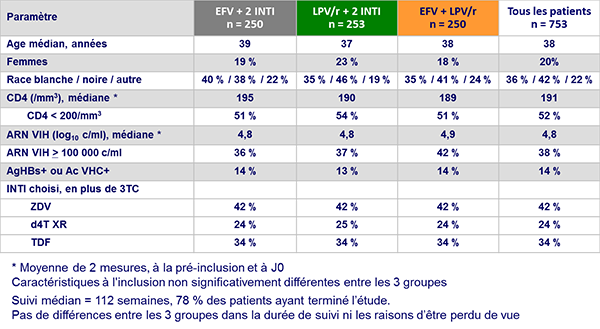
Caractéristiques à l'inclusion :
Probabilité d’absence d’échec virologique (%) :
ARN VIH < 50 c/ml :
Evénements cliniques ou anomalies biologiques de grade 3 ou 4 :
Mutations de résistance à l’échec virologique :
 Retour au sommaire Retour au sommaire
|



