Comparación de combinaciones de INTR
Estudio AMBER: D/C/F/TAF QD vs D/C + F/TDF QD
Artículo original : Eron J, EACS 2017, Abs. PS8/2
Última actualización : 07/03/2018
Pr Pedro Cahn
University of Buenos Aires
Buenos Aires, Argentina
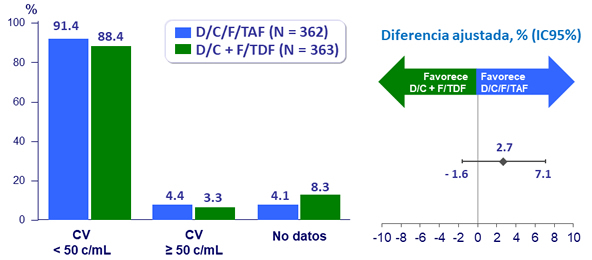
- A semana 48, D/C/F/TAF resultó en una alta tasa de supresión virológica en pacientes naïve de tratamiento (91.4% ; FDA snapshot ) que fue no inferior a DRV/C + F/TDF (88.4%)
- No se observó desarrollo de resistencia a DRV, primaria a IP o TDF/TAF
- Un paciente desarrolló la mutación M184I/V (rama D/C/F/TAF)
- Pocos eventos adversos serios, EA grado 3/4 o EA relacionados a discontinuación
- No discontinuaciones por evento adverso óseo, renal o de SNC
- La seguridad en cuanto a hueso, riñón y lípidos fue consistente con los perfiles conocidos de TAF y cobicistat
Diseño
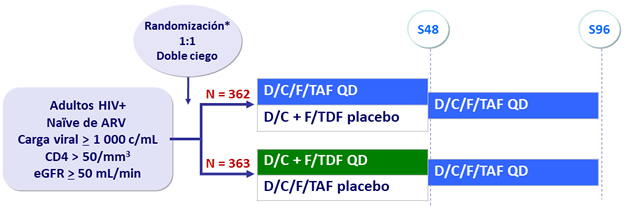
*
La randomización fue estratificada por carga viral (< o ≥ 100 000 c/mL) y CD4 (< o ≥ 200/mm3)
Objetivo
- No inferioridad de E/C/F/TAF a S48: % CV < 50 c/ mL por intención de tratar, análisis snapshot (margen inferior de IC95% para la diferencia = -10%)
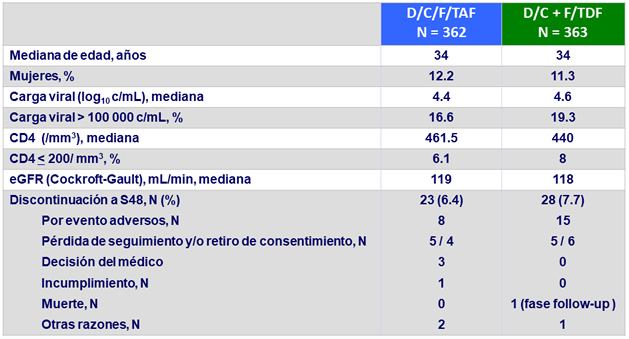
Características basales y disposición de los pacientes
Resultados virológicos a S48 (ITT, snapshot)
Análisis de resistencia
- Fallo virológico con genotipos pareados (basal y fallo con CV ≥400 c/ mL ), N = 9
[7 D/C/F/TAF + 2 D/C + F + TDF]: 1 paciente con emergencia de M184I/V (D/C/F/TAF)
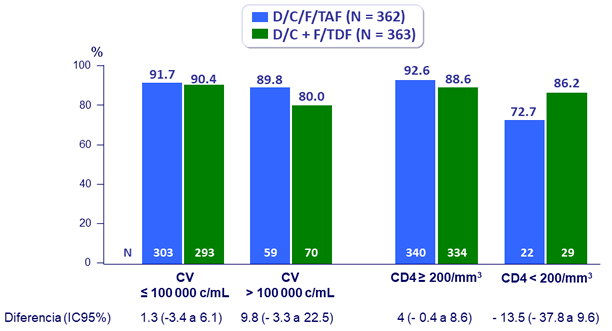
Resultados virológicos a S48 por estratificación basal (ITT, snapshot)
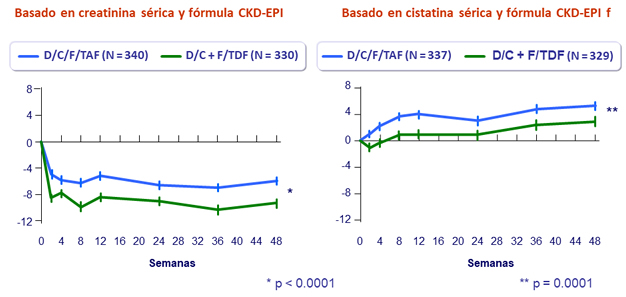
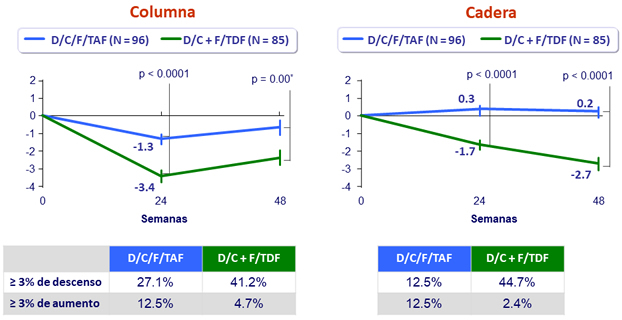
Media (ES) de cambio desde el basal en eGFR (mL/min/1.73m²)
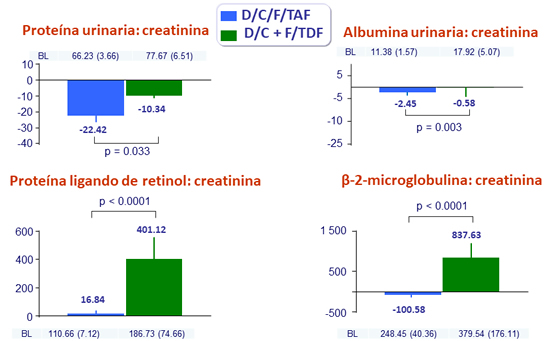
Media (SE) de cambio (mg/g) en proteinuria a S48
Media (SE) % de cambio en densidad mineral ósea a S48
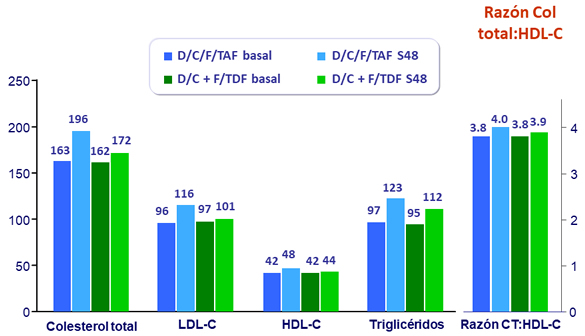
Valores de lípidos, mediana (mg/dL)
Eventos adversos a S48, %
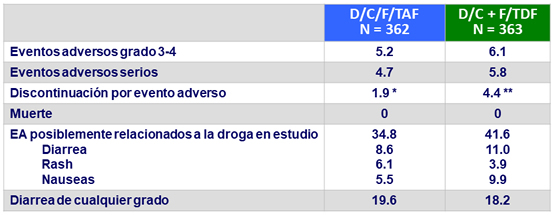
* rash (N = 6); diarrhea (N = 1)
** rash/ eritema (N = 7), diarrea (N = 1), toxidermia (N = 2), Sindrome de Stevens-Johnson (N = 1), Edema de médula ósea (N = 1), aumento de beta-2 macroglobulina (N = 1), artralgia (N = 1), neoplasia (N = 2)
- No se observaron anormalidades de laboratorio grado 3 o 4 en ≥ 5% de los pacientes en ninguna rama
- No discontinuación de D/C/F/TAF por evento adverso oseo , renal o de SNC



