|
Essais cliniques comparatifs pour le traitement antirétroviral de 1ère ligne depuis 2006
Comparaison des combinaisons d’INTI
Etudes GS-US-292-0104 et GS-US-292-0111
:
E/C/F/TAF QD vs E/C/F/TDF QD
Article original :
Sax PE. Lancet 2015; 385:2606-15, Wohl D. J Acquir Immune Defic Syndr 2016; 72:58-64 & Arribas JR, CROI 2017, Abs. 453
Dernière mise à jour :
07/04/2017
Pr François Raffi
Centre Hospitalier Universitaire
Nantes, France
- E/C/F/TAF QD est virologiquement non inférieur à E/C/F/TDF QD
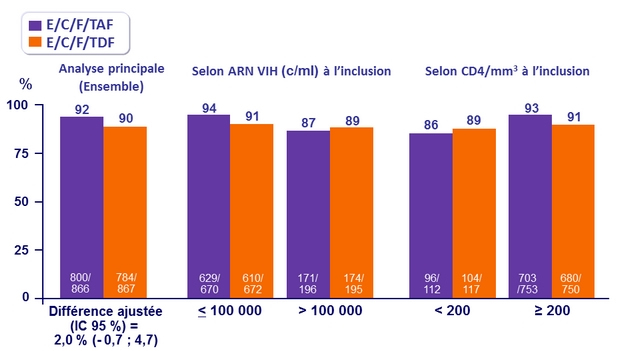
- 92 % des patients traités par E/C/F/TAF obtiennent une suppression virologique à S48
- Taux élevés et similaires de réponse, quels que soient la CV et les CD4 initiaux, le sexe, l'âge, la race
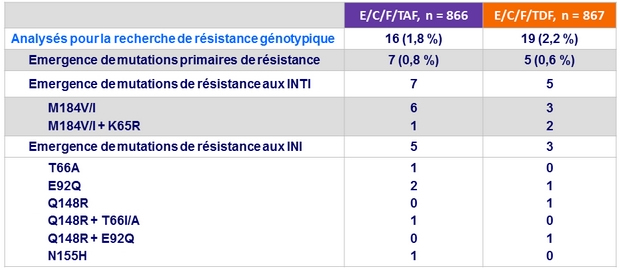
- Faible taux d'échec virologique, avec émergence de résistance < 1 % dans chaque bras
- Réponse CD4 significativement plus élevée avec E/C/F/TAF
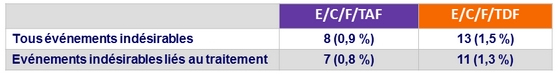
- Arrêt pour événement indésirable : 0 , 9 % vs 1 , 5 %
- Arrêt pour événement rénal : 0 vs 4
- Fréquence similaire des événements indésirables dans les 2 bras
- Pas de cas de tubulopathie proximale
- En comparaison à E/C/F/TDF, E/C/F/TAF a montré
- Une diminution significativement moindre du DFGe
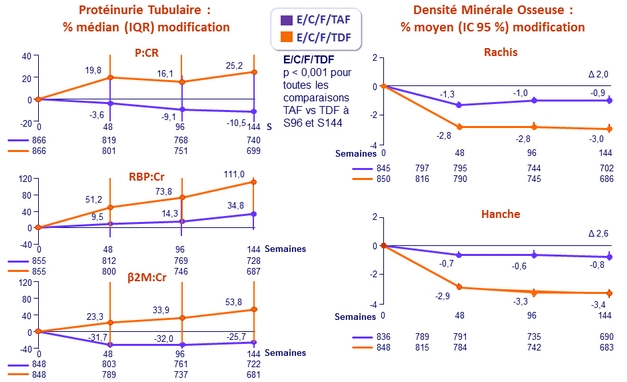
- Significativement moins de protéinurie, albuminurie, et protéinurie tubulaire
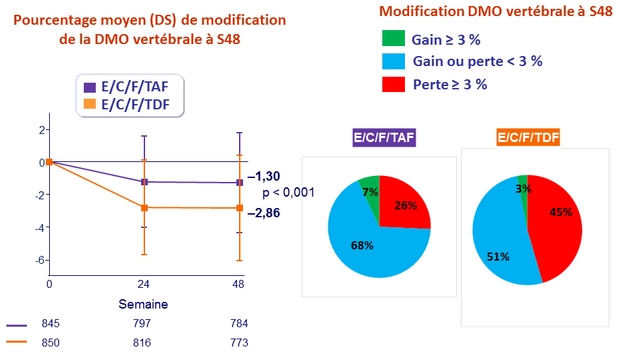
- Significativement moins d'impact sur la DMO du rachis et de la hanche
- Une augmentation plus importante des lipides
Schéma
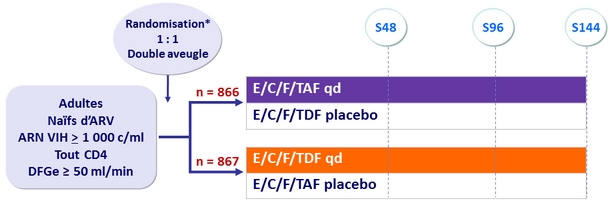
*
Randomisation stratifiée sur ARN VIH ( < ou > 100 000 c/ml), CD4 à l'inclusion, et région géographique
Objectifs :
- Non infériorité de E/C/F/TAF à S48 : % ARN VIH < 50 c/ml en intention
de traiter, analyse snapshot (borne inférieure de l'IC 95 %
de la différence = -12 %)
- Tolérance : créatinine sérique, protéinurie, DMO hanche et vertèbre
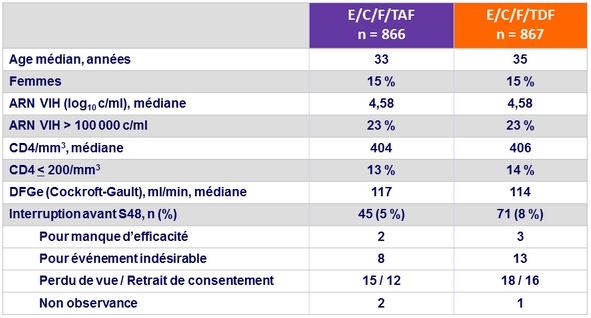
Caractéristiques à l'inclusion et devenir des patients
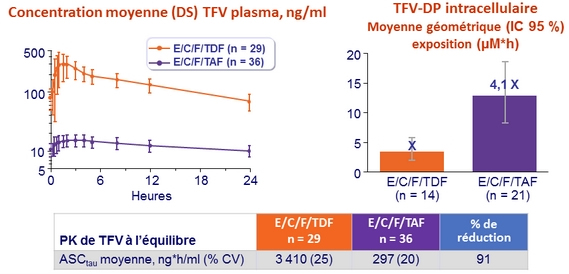
Taux plasmatique de TFV et intracellulaire de TFV-DP
- Sous-étude pharmacocinétique :
- E/C/F/TAF, n = 36 (sous-étude PBMC : 21/36)
- E/C/F/TDF, n = 29 (sous-étude PBMC : 14/29)
Réponse au traitement à S48
ARN VIH < 50 c /ml, ITT snapshot
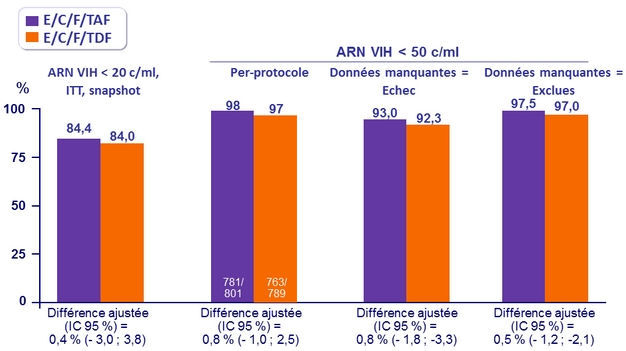
Critères secondaires
Critères pour réalisation d'un test de résistance
- 2 ARN VIH consécutifs > 50 c/ml (avec le second ≥ 400 c/ml) après obtention ARN < 50 c/ml, ou ARN VIH > 400 c/ml à S48 ou à la dernière visite
Données de résistance à S48
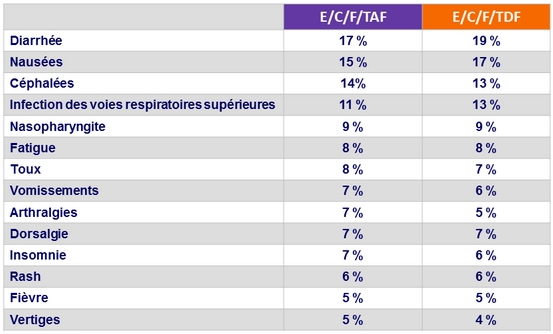
Evénements indésirables (tous grades) survenant chez ≥ 5 %
des patients dans un des groupes (S48)
Evénements indésirables conduisant à l'arrêt du traitement
Décès

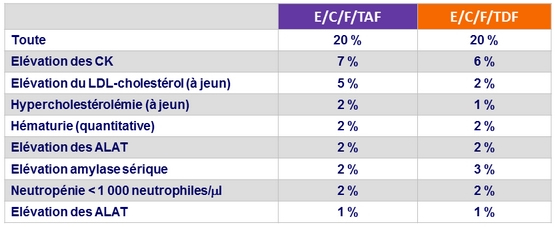
Anomalies biologique de grade 3 ou 4 chez ≥ 1 % des patients
dans un des groupes (S48)
Arrêt pour événement rénal
- E/C/F/TAF = 0
- E/C/F/TDF =
4 : insuffisance rénale = 2, diminution du DFG = 1,
néphropathie = 1
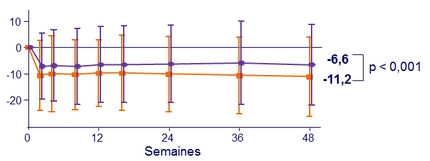
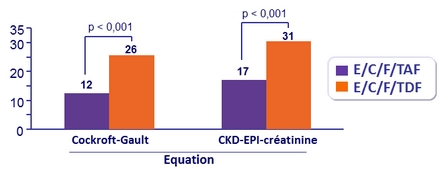
Modification moyenne (DS) du DFGe (Cockcroft-Gault), ml/min, depuis l'inclusion
Patients avec baisse ≥ 25 % du DFGe
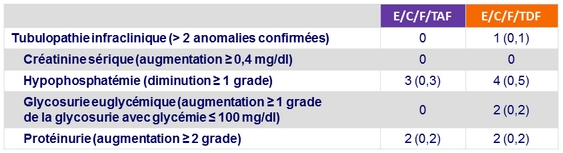
Anomalies biologiques rénales à S48, n (%)
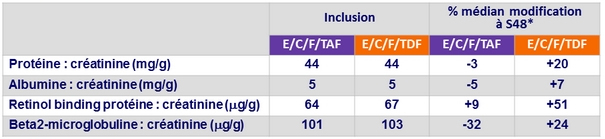
Modification des rapports protéinurie quantitative/ creatininurie à S48
*
p < 0 , 001 pour toutes les comparaisons

Lipides à jeun à S48

Patients initiant un hypolipidémiant entre J0 et S48 : 3,6 % E/C/F/TAF vs 2,9 % E/C/F/TDF (p = 0,42)
ARN VIH < 50 c/ml à S96 et S144
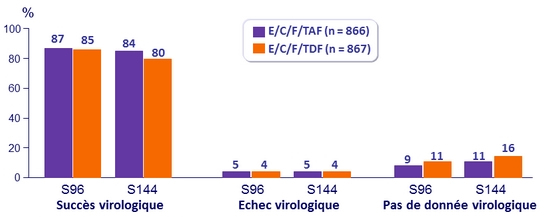
Différence de taux de succès virologique (IC 95%)
- ‒ S96 : 1,5 % (-1,8 à 4,8)
- S144 : 4,2 % (0,6 à 7,8) ; p = 0,02
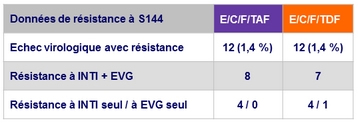
Evénements rénaux conduisant à l'arrêt du traitement à S144
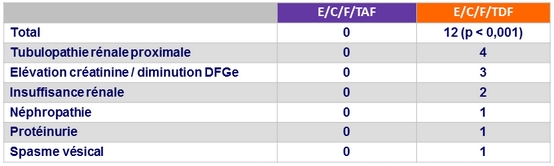
Evénements indésirables conduisant à l'arrêt du traitement à S144
- 1,3 % E/C/F/TAF vs 3,3 % E/C/F/TDF (p = 0,01)
Evénements indésirables de grade 3-4
- Pas de différence entre les 2 groupes à S144, sauf pour
- Elévation LDL-cholestérol : 11,0 % E/C/F/TAF vs 4,8 % E/C/F/TDF
- Elévation cholestérol : 4,7 % vs 2,8 %
- Elévation lipase : 5,0 % vs 8,0 %
- Elévation amylase : 2,6 % vs 5,0 %
 Retour au sommaire Retour au sommaire
|



