Etudes de switch chez les patients avec charge virale indétectable
Switch de TDF pour TAF
Etude GS-US-366-1160 : switch EFV/FTC/TDF
pour RPV/FTC/TAF
Article original : De Jesus E. Lancet HIV 2017; 4:e205-13
Dernière mise à jour : 01/06/2017
Pr François Raffi
Centre Hospitalier Universitaire
Nantes, France
- Globalement, chez les patients infectés par le VIH et contrôlés virologiquement, le switch pour rilpivirine, emtricitabine, et tenofovir alafenamide a permis de maintenir une charge virale indétectable à S48 de manière identique à la poursuite de la trithérapie avec efavirenz, emtricitabine, et tenofovir disoproxil fumarate
- Le traitement en 1 seul comprimé par jour de rilpivirine, emtricitabine, et tenofovir alafenamide était bien toléré avec amélioration significative des paramètres osseux et rénaux
Schéma
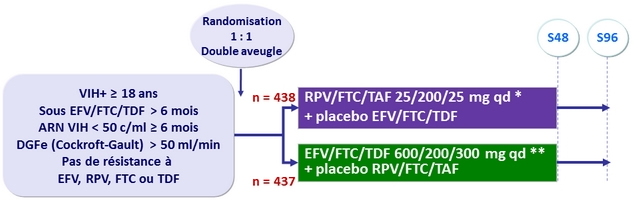
*
Avec aliments, le matin
**
Sans aliments, le soir
Critères de jugement
- Principal : pourcentage de patients conservant un taux d'ARN VIH < 50 c/ml à S48 (ITT, snapshot) ; non infériorité avec une limite de l'IC 95,001 % bilatéral de la différence = - 8 %, puissance de 95 %
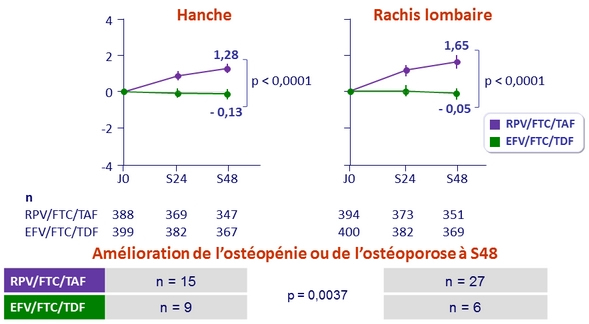
- Secondaires : pourcentage de modification de la densité minérale osseuse de la hanche et du rachis entre les 2 groupes ; puissance de 95 % de mettre en évidence une différence de 1,38 % (non infériorité)
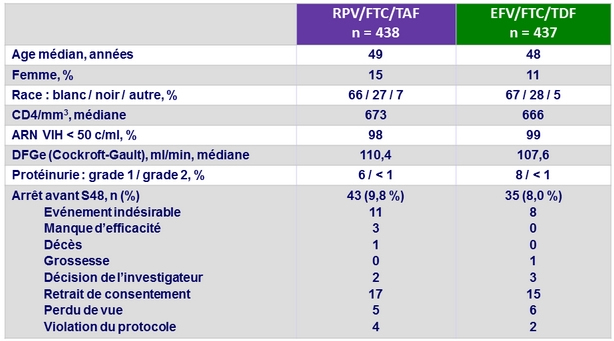
Caractéristiques à l'inclusion et devenir des patients
Résultats virologiques à S48 (ITT, snapshot )
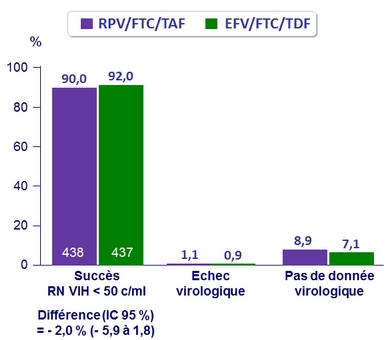
Autres données à S48
- Analyse per protocole
(ARN VIH < 50 c/ml)
- ‒99,1 % RPV/FTC/TAF ‒
- 99,3 % EFV/FTC/TDF
- Succès virologique identique entre les 2 bras pour les sous-groupes d'âge, sexe, race, et région géographique
- Si observance ≥ 95 % : succès virologique moindre dans bras ‒
- RPV/FTC/TAF : 91 % vs ‒
- EFV/FTC/TDF : 95 %
- Modification moyenne CD4/mm3 ‒
- + 23 RPV/FTC/TAF
- + 12 EFV/FTC/TDF
Analyse de la résistance
- Génotype et phénotype réalisés si ARN VIH confirmé ≥ 50 c/ml
et ARN VIH ≥ 400 c/ml sur l'échantillon de confirmation, ou si ARN VIH ≥ 400 c/ml à S48 ou à la dernière visite sous traitement de l'étude
- 6 patients dans le bras RPV/FTC/TAF : pas d'émergence de mutations de résistance ; 4 réobtiennent ARN VIH < 50 c/ml sans modification de traitement
- 2 patients dans le bras EFV/FTC/TDF : émergence de résistance à FTC (M184V) et RPV (V106I/L + Y188L)
- Sur les génotypes historiques : présence de mutations de résistance
à un ARV de l'étude chez 3 participants
- 2 patients dans le bras RPV/FTC/TAF (K103N ; E138A)
- 1 patient dans le bras EFV/FTC/TDF (K103N)
- Tous les 3 ont arrêté le traitement à S36 ou S48 avec ARN VIH < 50 c/ml
Evénements indésirables, %
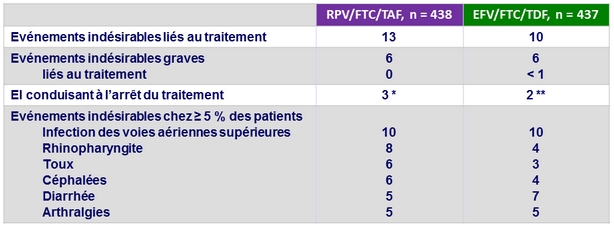
* Anémie (n = 1), diarrhée (n = 1), vomissements (n = 1), constipation (n = 1), asthénie (n = 2), hémorragie sur ulcère (n = 1), infection localisée (n = 1), fractures multiples (n = 1), accident de la route (n = 1), dysgueusie (n = 1), céphalées (n = 1), somnolence (n = 1), anxiété (n = 1), toux (n = 1), baisse DFG (n = 1), prurit généralisé (n = 1)
** Fibrillation auriculaire (n = 1), diarrhée (n = 1), vomissements (n = 1), distension abdominale (n = 1), douleur abdominale (n = 1), constipation (n = 1), dysphagie (n = 1), RGO (n = 1), nausées (n = 1), hypersensibilité (n = 1), sinusite (n = 1), arthralgies (n = 1), confusion (n = 1), insomnie (n = 1), asthme (n = 1), éruption cutanée (n = 1)
- 1 patient est décédé d'overdose de méthamphétamine et de cocaïne dans le bras RPV/FTC/TAF
Modification des marqueurs rénaux à S48
Rapport protéine : créatinine urinaire (% de modification médiane)
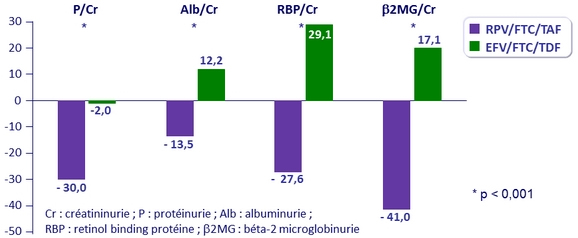
- Modification médiane DFGe : - 4,1 mg/dl sous RPV/FTC/TAF vs - 0,6 mg/dl sous EFV/FTC/TDF (p < 0,0001)
- 1 patient a arrêté le traitement pour baisse du DFGe (de 54,2 à 26,4 ml/min) dans le bras RPV/FTC/TAF
- Pas de cas de tubulopathie proximale ou de syndrome de Fanconi dans les 2 groupes
% moyen de modification de la densité minérale osseuse à S48 (%, IC 95 %)
Modification des lipides à jeun à S48
- Diminution du cholestérol total, du LDL-cholestérol, du HDL-cholestérol et des triglycérides dans le bras RPV/FTC/TAF
- Valeurs stables dans le bras EFV/FTC/TDF
- Modification du rapport cholestérol total:HDL-cholestérol similaire
dans les 2 groupes
- Début d'un traitement hypolipidémiant entre J0 et S48 : 4 %
dans chaque groupe
 Retour au sommaire Retour au sommaire
|



