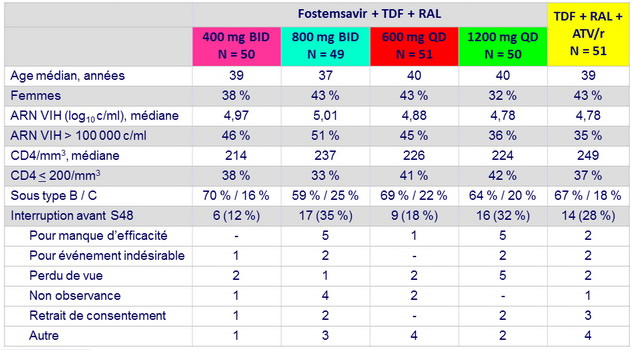
Caractéristiques initiales et devenir des patients
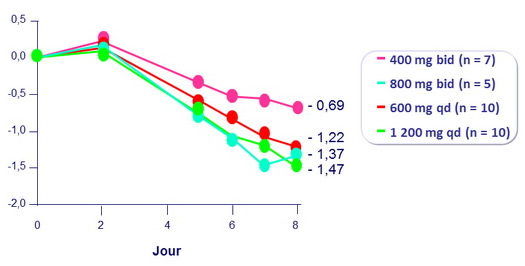
7 jours de monothérapie de fostemsavir
Modification moyenne ARN VIH (log 10 c/ml)
ARN VIH < 50 c/ mL ou < 400 c/ mL à S24
ARN VIH< 50 c/ml à S24 selon ARN VIH à l'inclusion (observé)
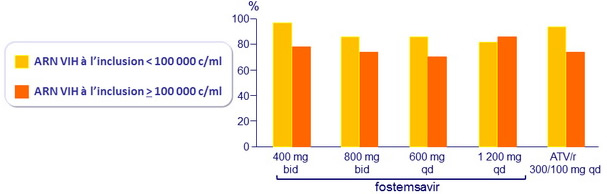
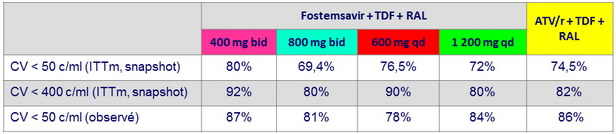
ARN VIH < 50 c/ml ou < 400 c/ml à S48, ITTm snapshot
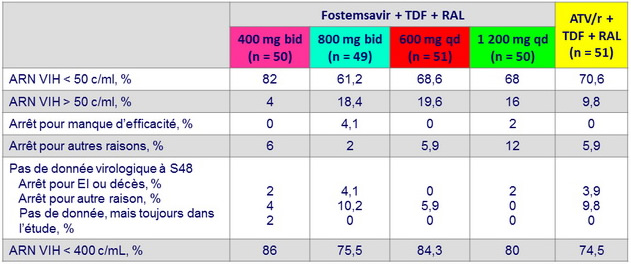
ARN VIH < 50 c/ml à S48, observé

Tolérance à S48
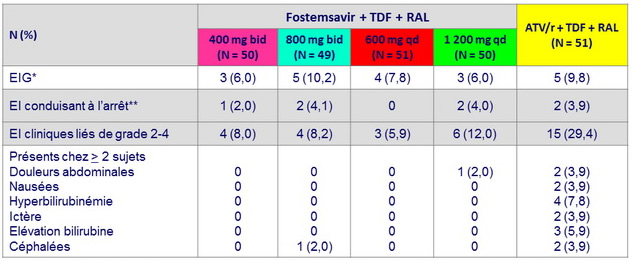
* Abcès anal, encéphalite herpétique, overdose (3), tuberculose extra-pulmonaire (2), zona, douleur abdominale, myalgies,
avortement spontané, insuffisance rénale aiguë, cellulite (2), lymphangite, cholécystite, dorsalgie, pneumonie, pyélonéphrite,
diarrhée, cholélithiase , migraine
** usage drogue illégale, tuberculose extra-pulmonaire (3), insuffisance rénale aiguë, distension abdominale, flatulence, nausées, ictère ; 6/7 des EI conduisent à l'arrêt de l'étude dans les 24 premières semaines
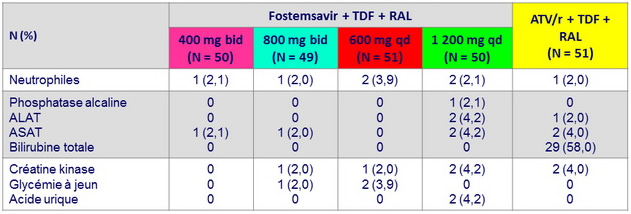
Anomalies biologiques grade 3-4 (≥ 2 sujets)
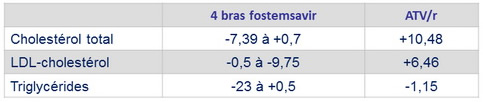
Modification moyenne à S48 des lipides à jeun, mg/dl