|
Fase 2 de nuevos ARVs
TAF (TFV prodrug)
Estudio 292-0102: EVG/c/FTC/TAF QD
vs EVG/c/FTC/TDF QD (Fase 2)
Artículo original : J Acquir Immune Defic Syndr. 2014 Sep 1;67(1):52-8 - PE Sax
Última actualización : 14/11/2014
Pr Pedro Cahn
University of Buenos Aires
Buenos Aires, Argentina
- Resumen de resultados a semana 48
- En este estudio de fase 2, randomizado, pacientes adultos HIV-positivos, naïve recibieron DFCs de E/c/F/TAF o E/c/F/TDF. Ambas dosis fijas combinadas (DFCs) demostraron altas y comparables tasas de supresión virológica a las 48 semanas de terapia
- Ambos regímenes fueron bien tolerados, con pocas discontinuaciones debidas a eventos adversos. Las náuseas ocurrieron mas frecuentemente con E/c/F/TAF
- Las concentraciones plasmáticas de TFV fueron substancialmente (91%) mas bajas con E/c/F/TAF que con E/c/ F/TDF, y el régimen TAF liberó 5.3 veces el metabolito intracelular, fisiológicamente activo TFV-DP, a PBMC, lo que podría trasladarlo en menor toxicidad y/o mejor control virológico
- Significativa menor reducción en DMO a semana 48 con E/c/F/TAF que con E/c/F/TDF
- Las razones RBP/creatinina y beta-2 microglobulina/creatinina en orina fueron significativamente mas bajas en la rama E/c/F/TAF, lo que sugiere que TAF tiene un efecto menor que TDF sobre las células del túbulo proximal renal.
Diseño :
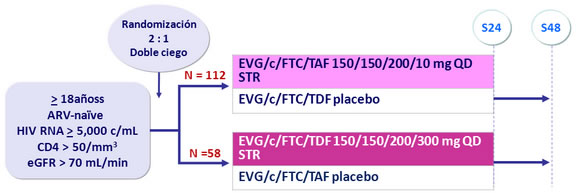
*Randomización estratificada por HIV RNA (< o > 100,000 c/mL) en el screening
Objetivo Primario :
- Determinar la eficacia virológica de EVG/c/FTC/TAF
- 150 pacientes proveen un poder del 76% para detectar una diferencia de 1.5% (DS de 3.3%) en la densidad mineral ósea en la rama EVG/c/FTC/TAF rama comparada con la rama EVG/c/FTC/TDF
Características basales :
Carga viral basal (mediana): 4.6 log10 c/mL (21% > 100,000 c/mL), �mediana de CD4: 391 c/mm3 (15% > 200/mm3)
Principales resultados :
- Discontinuación por eventos adversos a S48: 4 en rama TAF vs 0 �en rama TDF
- HIV RNA < 50 c/mL a S24: 87.5% E/c/F/TAF vs 89.7% E/c/F/TDF
- 3 pacientes en cada rama alcanzaron criterios para testeo de resistencia �(fallo virológico [2 cargas virales consecutivas > 50 c/mL] �con HIV RNA > 400 c/mL). El genotipo se efectuó en la muestra confirmatoria
- E/c/F/TAF: no se detecto resistencia
- E/c/F/TDF: 2 pacientes desarrollaron resistencia, 1 a INTR, 1 a INSTI + INTR
- Subestudio PK: la exposición plasmática de TFV fue 91% menor con E/c/F/TAF que con E/c/F/TDF, medida por AUCtau. A la inversa, los niveles intracelulares de TFV-DP en PBMC fueron 5.3-veces mayores con E/c/F/TAF
Seguridad :
- Significativo menor cambio en la rama E/c/F/TAF en DMO* en la cadera �(-0.62% vs -2.39%, p < 0.001) y columna lumbar (-1.0% vs -3.37%, �p < 0.001) a S48, también significativos a semana 24
- En la rama E/c/F/TAF, 32% de los pacientes no presentaron reducción en DMO en cadera vs 7% en la rama E/c/F/TDF (p < 0.001)
- Mediana de cambios en el eGFR** por Cockcroft-Gault= -5.5 mL/min para E/c/F/TAF vs -10.1 mL/min para E/c/F/TDF (p = 0.041)
- Proteinuria renal tubular (proteína urinaria ligando de retinol; razón proteína/creatinina y b-2 microglobulina/creatinina) fue significativamente menor en pacientes que recibieron E/c/F/TAF: no hubo casos de tubulopatía proximal
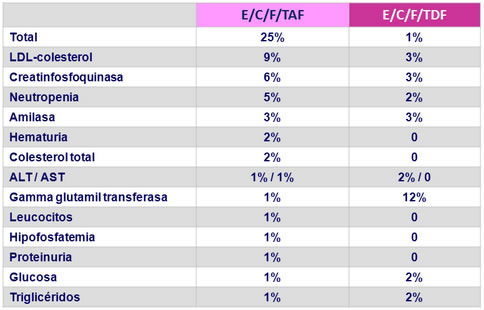
- Eventos adversos grado 3-4 : 9.8% TAF vs 5.2% TDF
- Eventos adversos emergentes mas comunes: nausea (21% vs 12%), �diarrea (16% en cada rama)
- Mayores elevaciones en lípidos con TAF
* DMO: densidad mineral ósea; ** eGFR: Filtrado glomerular estimado
Anormalidades de laboratorio grado 3 :
 Regresar al índice de materias Regresar al índice de materias
|



