Estudios comparativos para TARV de primera línea desde 2006
Comparación de IP vs IP
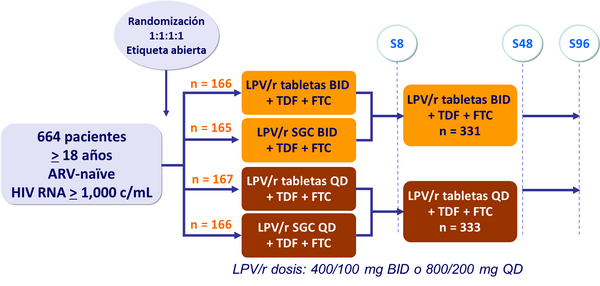
Estudio M05-730: LPV/r QD vs BID, �en combinación con TDF + FTC QD
Artículo original : J Acquir Immune Defic Syndr. 2009 Apr 15;50(5):474-81 - J Gathe
Última actualización : 28/03/2014
Pr Pedro Cahn
University of Buenos Aires
Buenos Aires, Argentina
- En adultos vírgenes de ARV, LPV/r QD fue virologicamente no inferior a �las 48 semanas al LPV/r BID, administrado en combinación con TDF y FTC
- Durante las primeras 48 semanas de terapia, no hubo diferencias significativas en la seguridad o tolerabilidad de LPV/r QD vs BID
- Este estudio usó tabletas de LPV/r, y no mostró diferencias en la incidencia de diarrea entre las posologías QD y BID
- En subgrupos con alta carga viral basal y/o bajo recuento de CD4, la eficacia de LPV/r QD y BID fue similar
- Ausencia de emergencia de resistencia al LPV/r o TDF, en ambos grupos
- Impacto limitado y similar en lípidos con ambas posologías de LPV/r
- Los pacientes prefirieron la tableta sobre la capsula blanda
- Los resultados fundamentan el uso de LPV/r QD en combinación con TDF y FTC en pacientes naïve de ARV
Diseño :
Objetivos :
- Endpoint primarios : HIV RNA < 50 c/mL a S48 (ITT, NC=F)
- No inferioridad de LPV/r QD vs BID si el margen inferior de la diferencia �para el IC de 95% CI era = - 12% (poder > 90%)
BID: cada 12 hs; QD: 1 dosis diaria
Disposición y características basales :
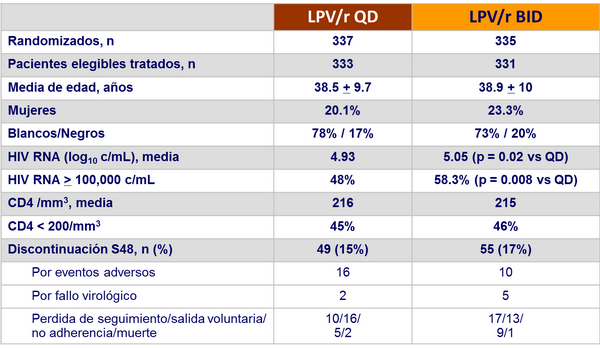
Respuesta al tratamiento a semana 48 :
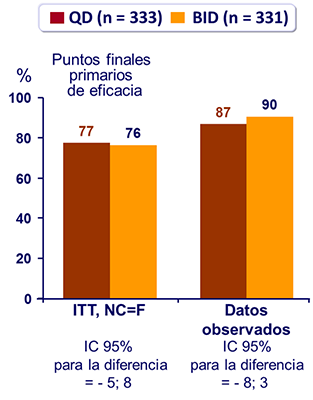
- Media de aumento de CD4 a S 48: 186/mm3 (QD) vs 198/mm3 (BID) (p = 0.32)�
- Análisis de sensibilidad ITT, NC=F, ajustando para disbalance basal en la carga viral confirma la no inferioridad en la respuesta virológica (IC 95% para la diferencia = - 6; 7)�
- Análisis post hoc de subgrupos :
- % carga viral < 50 c/mL similar en S48 con LPV/r QD y BID, en subgrupos según HIV RNA (< o > 100,000 c/mL) o recuento de CD4 �(< 50, 50 a < 200 o > 200/mm3)
- Para pacientes con CV basal�> 100,000 c/mL y CD4 < 200/mm3,�HIV RNA < 50 c/ml = 74% QD vs 73 % BID
-
Eventos adversos y resistencia :
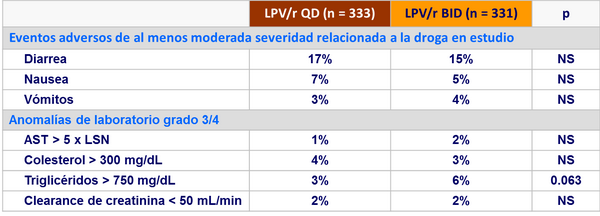
- Durante las primeras 8 semanas de tratamiento
- Eventos clínicos (gastrointestinales) y de laboratorio (lípidos): tolerabilidad similar para capsulas blandas y tabletas
- Resistencia
- En 17 pacientes (10 QD y 7 BID) testeados para resistencia (HIV RNA > 50 c/mL en o después de S24 y CV confirmada > 400 c/mL en 4 semanas): no emergencia de mutaciones de resistencia a IP �o TDF M184V emergió en 3 pacientes (2 QD, 1 BID)
-
 Regresar al índice de materias Regresar al índice de materias
|



